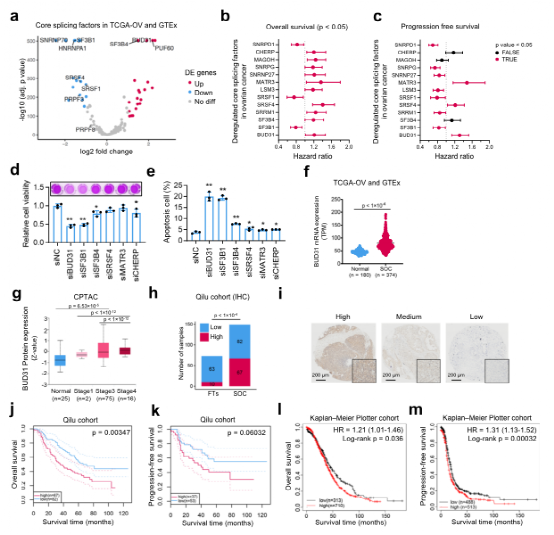
剪接因子的异常表达在肿瘤的发生发展中起着重要作用。然而,识别癌症特异性剪接变异体仍然是一个挑战。在这里,我们证明剪接体成分BUD31在卵巢癌中增加,其高表达预示着更差的预后。我们对BUD31结合基序进行了表征,发现BUD31优先结合剪接位点附近的外显子-内含子区域。进一步的分析表明,BUD31抑制导致广泛的外显子跳跃和减少含有完整编码序列的长亚型的生产。特别是,我们发现BCL2家族成员Bcl2L12是BUD31的功能剪接靶点之一。BUD31刺激外显子3的包含以产生全长Bcl2L12,并促进卵巢癌的进展。BUD31的敲除或剪接转换反义寡核苷酸处理促进了外显子3的跳过,并导致Bcl2L12的截断异构体经历无义介导的mRNA衰变,随后细胞发生凋亡。我们的发现揭示了BUD31调控的外显子包涵体是卵巢癌细胞存活和癌症进展的关键因素。题目:Splicing factor BUD31 promotes ovarian cancer progression through sustaining the expression of anti-apoptotic BCL2L12译名:剪接因子BUD31通过维持抗凋亡基因Bcl2L12的表达促进卵巢癌进展DOI号:https://doi.org/10.1038/s41467-022-34042-w卵巢癌是最致命的生殖癌症,全球每年有超过18.4万人死亡。超过75%的卵巢癌患者被诊断为晚期,没有有效的筛查策略。晚期卵巢癌的标准治疗方法是细胞减灭术,然后是以铂为基础的化疗。然而,大多数患者会患上对铂耐药的疾病。血管生成和PARP抑制剂在卵巢癌的治疗中显示出良好的临床效果。最近的研究表明,ATR抑制克服了PARP抑制剂和卵巢癌细胞对铂的耐药性。Wee1抑制剂已被证明可以增敏化疗,特别是在TP-53突变的卵巢癌中。尽管取得了这些进展,但复发和化疗耐药仍然是一个主要的临床问题。剪接因子的异常表达和干扰剪接已被证明是肿瘤发生的驱动因素。我们使用TCGA数据对SOC中与生存相关的剪接因子进行了筛选。我们发现BUD31在SOC中普遍过表达,高水平的BUD31与预后不良相关,泛癌分析显示BUD31在不同的癌症类型中过表达。我们接下来研究了BUD31的功能作用,发现BUD31促进了卵巢癌细胞的增殖和存活以及异种移植瘤的生长。在乳腺癌细胞中,BUD31是细胞迁移所必需的。提示BUD31具有致癌潜能,与卵巢癌患者的不良预后密切相关。合成致命性筛查为癌症治疗提供了一种很有前途的策略。PARP抑制剂是第一批临床批准的药物,基于它们对BRCA1/2突变卵巢癌的合成致死性。在MYC激活状态下,BUD31已被鉴定为MYC合成的致死基因,BUD31是剪接体组装和催化活性所必需的。MYC-高活性细胞中BUD31的缺失导致整体内含子保留。然而,BUD31调控的癌症特异性剪接事件及其结合基序在很大程度上仍不清楚。我们进行了CLIP-SEQ来绘制全基因组BUD31-RNA相互作用图,发现BUD31结合位点在3‘和5’剪接位点附近的外显子-内含子区域高度丰富。我们进一步揭示了BUD31抑制导致广泛的外显子跳跃。我们还使用HOMER算法鉴定了四个与BUD31结合的RNA基序。在对CLIP-SEQ、RIP-SEQ和RNA-SEQ数据的联合分析中,我们确定了可能参与BUD31介导的卵巢癌细胞存活和增殖的多个潜在的直接结合靶点(Bcl2L12、RBCK1、E2F4和CDK16)。这些发现表明,BUD31通过直接结合其RNA靶标在全球范围内调节AS。Bcl2L12已被确定为胶质母细胞瘤的治疗靶点。针对Bcl2L12的基于RNA干扰的球形核酸已经在胶质母细胞瘤的0期人类首次试验中进行。在酵母双杂交系统中,Bcl2L12还与bcl2和bclxl相互作用。在肠道方面,我们发现Bcl2L12基因的敲除降低了BCL2的蛋白水平,而Bcl2L12基因敲除后Bcl2L12的蛋白水平没有显著变化,这表明BUD31的失活导致BCL2的下调可能是Bcl2L12下调的结果。Bcl2L12在人脑胶质母细胞瘤中表达上调并阻断caspase-3和caspase-7的激活以抵抗细胞凋亡。Bcl2L12通过与P53的直接相互作用抑制P53依赖的DNA损伤诱导的细胞凋亡。重要的是,我们发现BUD31基因敲除促进了外显子3的跳过,从而影响了全长亚型Bcl2L12-L的表达。虽然由于BUD31的敲除,BCL2L12的截断亚型BCL2L12- s越来越多地产生,但它确实是NMD迅速降解,细胞随后发生凋亡。根据CLIP-SEQ和RIP-SEQ的数据,从机制上讲,BUD31与Bcl2L12的外显子3结合。EMSA和RNA下拉实验证实了BUD31蛋白和Bcl2L12前mRNA的相互作用。更重要的是,Bcl2L12-L在SOC中显著增加,较高的水平与较差的总体生存率相关。因此,我们的工作支持BUD31刺激外显子3的包含从而产生Bcl2L12-L并促进卵巢癌进展的观点。转录调控改变可能会增加BUD31的表达。MYC可以调节包括SRSF1在内的多种剪接因子的表达。然而,我们未能证实BUD31是MYC在卵巢癌中的直接靶点。我们分析了BUD31的启动子区域,发现了BUD31启动子区域潜在的E2F1结合部位,表明E2F1是BUD31在卵巢癌中潜在的转录因子。此外,BUD31在卵巢癌中的转录后或翻译后调控也可能参与调控。然而,需要进一步的研究来确定BUD31是如何在卵巢癌中过度表达的。综上所述,我们的研究提示BUD31在卵巢癌中可作为致癌剪接因子和预后标记物。我们进一步确定了BUD31的结合基序和全基因组结合模式。BUD31的过表达驱动Bcl2L12中的致癌剪接开关产生全长Bcl2L12,进而赋予癌细胞对凋亡的抵抗,促进卵巢癌细胞的增殖。抑制BUD31或使用ASOS可能为卵巢癌提供潜在的治疗策略。https://doi.org/10.1038/s41467-022-34042-w